1.1 Laju
Reaksi
Laju reaksi
adalah banyaknya pereaksi yang berkurang per satuan waktu atau banyaknya produk
yang terbentuk per satuan waktu. Jumlah zat yang berubah dinyatakan dalam
satuan volum total campuran. Oleh karena itu, laju reaksi didefinisikan sebagai
pertambahan konsentrasi molar produk reaksi per satuan waktu, atau pengurangan
konsentrasi molar pereaksi per satuan waktu. Satuan laju reaksi adalah mol per
liter per detik atau mol L-1s-1. Laju reaksi dipengaruhi
oleh frekuensi tumbukan efektif yang terjadi antar molekul. Semakin sering
terjadi tumbukan efektif maka laju reaksi akan semakin cepat. Dengan
meningkatkan frekuensi tumbukan efektif antar molekul, maka dapat dihasilkan
produk dalam waktu yang singkat (Keenan, 1986).
Bagaimanakah
cara menyatakan laju dari suatu reaksi? Dalam reaksi kimia, perubahan yang
dimaksud adalah perubahan konsentrasi pereaksi atau produk. Seiring dengan
bertambahnya waktu reaksi, maka jumlah zat pereaksi akan makin sedikit,
sedangkan produk makin banyak. Laju reaksi dinyatakan sebagai laju berkurangnya
pereaksi atau laju bertambahnya produk. Satuan konsentrasi yang digunakan
adalah molaritas (M) atau mol per liter (mol L-1). Satuan waktu yang
digunakan biasanya detik (dt). Sehingga laju reaksi mempunyai satuan mol per
liter per detik (mol L-1 dt-1 atau M dt-1).
1.1 Kinetika
Reaksi Homogen
Kinetika kimia adalah bagian
dari kimia fisika yang mempelajari
tentang kecepatan reaksi-reaksi kimia dan mekanisme reaksi-reaksi tersebut.
Termodinamika
kimia mempelajari hubungan tenaga antara pereaksi dan hasil-hasil reaksi, tidak
mempelajari bagaimana reaksi-reaksi tersebut berlangsung dan dengan kecepatan
berapa kesetimbangan untuk reaksi kimia ini dicapai. Hal terakhir ini
dipelajari dalam kinetika kimia, sehingga kinetika kimia merupakan pelengkap
bagi termodinamika kimia.
Tidak semua reaksi kimia
dapat dipelajari secara kinetik. Reaksi-reaksi yang berjalan sangat cepat
seperti reaksi-reaksi ion atau pembakaran dan reaksi-reaksi yang berjalan sangat
lambat seperti pengkaratan, tidak dapat dipelajari secara kinetik. Diantara
kedua jenis ini, banyak reaksi-reaksi yang kecepatannya dapat diukur(Sukardjo,
1997).
Kecepatan
reaksi ialah kecepatan perubahan konsentrasi pereaksi terhadap waktu, jadi dC/dt.
Tanda minus menunjukkan bahwa konsentrasi berkurang bila waktu berubah. Menurut
hukum kegiatan massa, kecepatan reaksi pada temperatur tetap, berbanding lurus
dengan konsentrasi pengikut-pengikutnya dan masing-masing berpangkat sebanyak
molekul dalam persamaan reaksi (Sukardjo, 1997).
dC/dt.
Tanda minus menunjukkan bahwa konsentrasi berkurang bila waktu berubah. Menurut
hukum kegiatan massa, kecepatan reaksi pada temperatur tetap, berbanding lurus
dengan konsentrasi pengikut-pengikutnya dan masing-masing berpangkat sebanyak
molekul dalam persamaan reaksi (Sukardjo, 1997).
Untuk reaksi :
n1A
+ n2B + n3C → hasil-hasil
(Sukardjo,
1997).
Laju
didefinisikan sebagai perubahan konsentrasi per satuan waktu. Umumnya laju
reaksi meningkat dengan meningkatnya konsentrasi, dan dapat dinyatakan sebagai
:
Laju ≈ k f (C1, C2,…….Ci)
(Dogra, dkk., 1990).
Dimana
k adalah konstanta laju, juga disebut konstanta laju spesifik atau konstanta
kecepatan, C1, C2,…. adalah konsentrasi dari
reaktan-reaktan dan produk-produk. sebagai contoh dalam hal reaksi umum (Dogra, dkk., 1990).
1.2 Faktor-faktor
yang Mempengaruhi Laju Reaksi
1.2.1
Konsentrasi
Telah diuraikan
dalam teori tumbukan, perubahan jumlah molekul pereaksi dapat berpengaruh pada
laju suatu reaksi. Kita telah tahu bahwa jumlah mol spesi zat terlarut dalam 1
liter larutan dinamakan konsentrasi molar. Bila konsentrasi pereaksi diperbesar
dalam suatu reaksi, berarti kerapatannya bertambah dan akan memperbanyak
kemungkinan tabrakan sehingga akan mempercepat laju reaksi. Bila partikel makin
banyak, akibatnya lebih banyak kemungkinan partikel saling bertumbukan yang
terjadi dalam suatu larutan, sehingga reaksi bertambah cepat.
1.2.2
Luas Permukaan Sentuhan
Pengaruh luas
permukaan banyak diterapkan dalam industri, yaitu dengan menghaluskan terlebih
dahulu bahan yang berupa padatan sebelum direaksikan. Ketika kita makan, sangat
dianjurkan untuk mengunyah makanan hingga lembut, agar proses reaksi di dalam
lambung berlangsung lebih cepat dan penyerapan sari makanan lebih sempurna. Apa
hubungannya dengan tumbukan? Makin luas permukaan gamping, makin luas bidang
sentuh dengan asam klorida makin besar, sehingga jumlah tumbukannya juga makin
besar. Artinya makin kecil ukuran, makin luas permukaannya, makin banyak
tumbukan, makin cepat terjadinya reaksi.
1.2.3
Suhu
Jika suhu
dinaikkan, maka kalor yang diberikan akan menambah energi kinetik partikel
pereaksi. Sehingga pergerakan partikel-partikel pereaksi makin cepat, makin
cepat pergerakan partikel akan menyebabkan terjadinya tumbukan antar zat
pereaksi makin banyak, sehingga reaksi makin cepat.
Energi kinetik
molekul-molekul tidak sama. Ada yang besar dan ada yang kecil. Oleh karena itu,
pada suhu tertentu ada molekul-molekul yang bertabrakan secara efektif dan ada
yang bertabrakan secara tidak efektif. Dengan perkataan lain, ada tabrakan yang
menghasilkan reaksi kimia ada yang tidak menghasilkan reaksi kimia.
Meningkatkan suhu reaksi berarti menambahkan energi. Energi diserap oleh
molekul-molekul sehingga energi kinetik molekul menjadi lebih besar. Akibatnya,
molekul-molekul bergerak lebih cepat dan tabrakan dengan dampak benturan yang
lebih besar makin sering terjadi. Dengan demikian, benturan antar molekul yang
mempunyai energi kinetik yang cukup tinggi itu menyebabkan reaksi kimia juga
makin banyak terjadi. Hal ini berarti bahwa laju reaksi makin tinggi.
1.2.4
Katalis
Salah satu cara
lain untuk mempercepat laju reaksi adalah dengan jalan menurunkan energi
pengaktifan suatu reaksi. Hal ini dapat dilakukan dengan menggunakan katalis. Katalis adalah zat yang dapat
meningkatkan laju reaksi tanpa dirinya mengalami perubahan kimia secara
permanen. Katalis dapat bekerja dengan membentuk senyawa antara atau
mengabsorpsi zat yang direaksikan. Suatu reaksi yang menggunakan katalis
disebut reaksi katalis dan prosesnya disebut katalisme. Katalis suatu reaksi
biasanya dituliskan di atas tanda panah.
Ada dua macam
katalis, yaitu katalis positif
(katalisator) yang berfungsi mempercepat reaksi, dan katalis negatif (inhibitor) yang
berfungsi memperlambat laju reaksi. Katalis positif berperan menurunkanenergi
pengaktifan, dan membuat orientasi molekul sesuai untuk terjadinyan tumbukan.
Sedangkan katalisator dibedakan atas katalisator homogen dan katalisator
heterogen.
1.2.5
Mekanisme
Reaksi
Beberapa reaksi
berlangsung melalui pembetukan zat antara, sebelum diperoleh produk akhir.
Reaksi yang demikian berlangsung tahap demi tahap. Mekanisme reaksi ialah
serangkaian reaksi tahap demi tahap yang terjadi berturut-turut selama proses
perubahan reaktan menjadi produk.
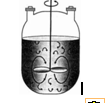
1.3 Reaktor
Batch
Reaktor batch digunakan dalam skala operasi kecil, untuk mencoba proses
baru yang belum sepenuhnya dikembangkan, untuk produksi produk mahal dan untuk
proses yang sulit dikonversi oleh operasi kontinu. Reaktor batch memiliki kelebihan yaitu dapat memberikan nilai konversi yang
tinggi, yang dapat diperoleh dengan membiarkan reaktan berada dalam reaktor
dalam jangka waktu yang lama. Kekurangannya adalah biaya yang mahal untuk
setiap batch, produk yang dihasilkan
dapat bervariasi dari batch yang satu
dengan batch yang lainnya, dan tidak
efektif untuk produksi skala besar.
Gambar 2.2 Reaktor Batch
(Fogler, 2006)
1.4 Bahan Baku
2.4.1 Asam Format (H3PO4)
Asam
format merupakan senyawa berbentuk cairan bersifat korosif, yang mempunyai
rumus molekul H3PO4, tekanan uap 0.0285 oC, titik beku-17,5 oC, dan
titik didih 158 °C. Larut dalam air dan pelarut organik.
Bersifat stabil pada suhu dan tekanan normal, namun tidak stabil dengan asam
dan basa kuat serta oksidator kuat.
2.4.2 Natrium Hidroksida
(NaOH)
Natrium hidroksida merupakan senyawa
berwujud padat dan berwarna putih yang memiliki berat molekul 40 g/mol. Senyawa
ini dikenal larut dalam air, alkohol, eter, dan gliserin, memiliki titik didih
sebesar 1390 °C dan titik leleh sebesar 318,4 °C. Apabila senyawa ini
dipanaskan pada temperature 1000 °C dengan pencampuran kabon akan membentuk metallic sodium.
Referensi
Azizah,
Utiya. 2004. Laju Reaksi. http://dartosaripan.fileave.com/10_laju_reaksi.pdf.
Diakses pada tanggal 1 April 2014.
Brother, Hill. 1978. Phormate Acid Safety Data Sheet. http://www.sipchem.com/. Diakses pada
tanggal 1 April 2014.
Davis, Robert J,
dkk. 2003. Fundamental of Chemical
Reactions Engineering. New York : McGraw – Hill.
Dogra, dkk.
2009. Kimia Fisika dan Soal – soal.
Jakarta : UI Press.
Fogler, H. Scott. 2004. Elements of Chemical Reaction Engineering.
Edisi Ketiga. New Delhi : Prentice Hall of India.
Keenan, dkk. 1986. General College Chemistry. Jilid 1. Edisi Keenam. New York :
Harper International.
Levenspiel,
Octave. 1999. Chemical Reaction
Engineering. Edisi Ketiga. New York : John Wiley & Sons.
Missen, Ronald
W, Charles A.
Mims, Bradley A. Saville.
1999.
Introduction
to Chemical Reaction Engineering and Kinetics. Amerika Serikat : John Wiley & Sons, Inc.
Sukardjo. 1997. Kimia Fisika.Edisi Ketiga. Jakarta :
Rineka Cipta.