BAB I
PENDAHULUAN
1.1 Latar
Belakang
Sifat koligatif,
yaitu sifat larutan yang hanya tergantung pada konsentrasi partikel zat
terlarut. Sifat koligatif tersebut terdiri atas penurunan tekanan uap, kenaikan
titik didih, penurunan titik beku, dan tekanan osmosis. Sifat koligatif larutan
dapat digunakan untuk menentukan massa molekul relatif, derajat ionisasi dan
jumlah ion zat terlarut.
Pada tekanan
udara luar 760 mmHg, air mendidih pada suhu 100°C. Dengan adanya zat terlarut
menyebabkan penurunan tekanan uap larutan, sehingga pada suhu 100°C larutan air
belum mendidih karena tekanan uapnya belum mencapai 760 mmHg. Untuk mencapai
tekanan uap 760 mmHg maka perlu dipanaskan lebih tinggi lagi akibatnya larutan
mendidih pada suhu lebih dari 100°C. Ini berarti bahwa titik didih larutan
lebih tinggi daripada titik didih pelarut murninya. Selisih antara titik didih
larutan dengan titik didih pelarut murni disebut kenaikan titik didih (DTb).
Adanya perbedaan
titik didih antara aquadest dengan larutan lainnya yang melatarbelakangi
percobaan ini dimana akan dicari seberapa besar kenaikan titik didih untuk
setiap run sampel percobaan.
1.2
Perumusan
Masalah
Adapun
perumusan masalah percobaan kenaikan titik didih ini adalah:
1. Bagaimana
menentukan kenaikan titk didih beberapa larutan dengan metode Landsberger.
2. Bagaimana
pengaruh konsentrasi zat dari berbagai larutan terhadap kenaikan titik didih
larutan.
3. Bagaimana
perbedaan kenaikan titik didih pada larutan elektrolit dan non elektrolit.
4. Bagaimana
perbedaan kenaikan titik didih dengan menggunakan sampel yang memiliki berat
molekul yang sama.
1.3 Tujuan Percobaan
Tujuan percobaan kenaikan titik didih ini adalah:
1. Menentukan
kenaikan titik didih dan penurunan tekanan uap dari beberapa larutan dengan
metode Landsberger.
2. Membuat
grafik konsentrasi versus titik didih.
3. Membuat
grafik fraksi mol zat terlarut versus penurunan tekanan uap.
4. Mempelajari
pengaruh berat molekul terhadap kenaikan titik didih.
1.4 Manfaat Percobaan
Manfaat dari percobaan
kenaikan titik didih ini adalah:
1. Praktikan
dapat menentukan kenaikan titik didih dengan metode Landsberger.
2. Praktikan
dapat membuat grafik konsentrasi versus titik didih.
3. Praktikan
dapat membuat grafik fraksi mol zat terlarut versus penurunan tekanan uap.
4. Memahami
pengaruh berat molekul terhadap kenaikan titik didih.
1.5 Ruang Lingkup Percobaan
Adapun
ruang lingkup dari percobaan ini adalah:
1. Praktikum
kenaikan titik didih ini dilaksanakan di Laboratorium Kimia Fisika Departemen
Teknik Kimia Fakultas Teknik Universitas Sumatera Utara.
2. Batasan
masalah pada percobaan ini adalah penentuan konsentrasi larutan, penentuan
titik didih larutan, penurunan tekanan uap dan hubungan antara konsentrasi
terhadap kenaikan titik didih larutan dan penurunan tekanan uap.
3. Bahan
yang digunakan dalam percobaan ini adalah Maltosa
(C12H22O11), Sukrosa (C12H22O11), Kalium Klorida (KCl), dan Aquadest (H2O),
sedangkan alat yang digunakan adalah labu distilasi, neraca elektrik,
termometer, gelas ukur, batang pengaduk, selang, pipa kapiler, bunsen, kaki
tiga, selotip, statif, klem, mancis, dan alumunium foil.
4. Percobaan
ini dilakukan berdasarkan metode Landsberger dan sebanyak 4 run percobaan untuk
setiap zat terlarut yang digunakan.
BAB II
TINJAUAN PUSTAKA
2.1 Sifat Koligatif Larutan
Bila suatu zat terlarut dilarutkan
dalam suatu pelarut murni, maka sifat larutan itu berbeda dengan pelarut murni.
Terdapat empat sifat fisik larutan yang mana empat sifat ini hanya bergantung
pada jumlah molekul (partikel) zat terlarut dalam larutan itu, tidak tergantung
pada jenis zat terlarut. Keempat sifat itu disebut dengan sifat koligatif
larutan. Yang termasuk sifat koligatif larutan adalah:
1. Penurunan
tekanan uap (ΔP)
2. Penurunan
titik beku (ΔTf)
3. Kenaikan
titik didih (ΔTb)
4. Tekanan
osmotik (π)
Keempat sifat itu nilainya hanya
bergantung pada jumlah partikel zat terlarut. Semakin besar jumlah partikel zat
terlarut, makin besar pula nilai sifat-sifat koligatifnya. Selain itu, keempat
sifat koligatif tersebut saling berhubungan satu sama lain. Bila salah satu
nilainya diketahui maka nilai-nilai lainnya dapat ditentukan. Tetapi baik
dipahami bahwa sifat koligatif larutan ini hanya berlaku normal bila
batasan-batasan di bawah ini dipenuhi yaitu:
1. Zat
terlarut harus tidak menguap (non-volatile)
2. Konsentrasi
zat terlarut kecil (larutan harus encer)
3. Zat
terlarut bukan zat elektrolit, jadi harus zat non-elektrolit
Di luar ketiga hal tersebut maka sifat
koligatif larutan akan menunjukkan penyimpangan (abnormal). Kegunaan terpenting
dari sifat koligatif ini adalah untuk menentukan berat molekul (Mr) suatu zat
dalam larutan (Kadri, 2009).
2.2
Tekanan Uap
Seperti dalam kasus gas, energi kinetik molekul
cairan tidak seragam tetapi bervariasi. Terdapat keteraturan dalam keragaman ini,
dan distribusi energi kinetik ditentukan oleh hukum distribusi Boltzmann. Hukum ini menyatakan bahwa partikel yang paling melimpah
adalah partikel dengan energi kinetik rata-rata, dan jumlah
partikel menurun dengan teratur ketika selisih energi kinetiknya
dengan energi kinetik rata-rata semakin besar.
Beberapa
molekul yang energi kinetiknya lebih besar dari energi kinetik rata-rata dapat
lepas dari gaya
tarik antarmolekul dan menguap. Bila cairan diwadahi dalam ruang tanpa tutup,
cairan akan perlahan menguap dan akhirnya habis. Bila
ruangnya memiliki tutup dan cairannya terisolasi, molekulnya
kehilangan energinya dengan tumbukan dan energi kinetik beberapa molekul
menjadi demikian rendah sehingga molekul tertarik dengan gaya
antarmolekul pada permukaan cairan dan kembali masuk ke
cairan. Ini adalahkondensasi uap dalam deskripsi makroskopik.
Akhirnya jumlah molekul yang menguap dari permukaan cairan dan
jumlah molekul uap yang kembali ke cairan menjadi sama mencapai
kesetimbangan dinamik. Keadaan ini disebut kesetimbangan
uap-cair.
Tekanan uap cairan adalah
salah satu sifat penting larutan. Dalam hal sistem biner, bila komponennya
mirip ukuran molekul dan kepolarannya, misalnya benzen dan toluen, tekanan uap
larutan dapat diprediksi dari tekanan uap komponennya. Hal ini karena sifat
tekanan uap yang aditif. Bila larutan komponen A dan komponen B dengan fraksi
mol masing-masing adalah xA dan xB berada dala
kesetimbangan dengan fasa gasnya tekanan uap masing-masing komponen sebanding
dengan fraksi molnya dalam larutan. Tekanan uap komponen A, pA,diungkapkan
sebagai:
pA = pA0 .
xA
pA0
adalah tekanan uap cairan A murni pada suhu yang sama. Hubungan yang mirip juga
berlaku bagi tekanan uap B, pB. Hubungan ini ditemukan oleh kimiawan
Perancis Francois Marie Raoult (1830-1901) dan disebut dengan hukum Raoult. Untuk larutan yang
mengikuti hukum Raoult, interaksi antara molekul individual kedua komponen sama
dengan interaksi antara molekul dalam tiap komponen. Larutan semacam ini
disebut larutan ideal (Takeuchi,
2006).
2.3 Titik Didih
Tekanan uap cairan
meningkat dengan kenaikan suhu dan gelembung akan terbentuk dalam cairannya.
Tekanan gas dalam gelembung sama dengan jumlah tekanan atmosfer dan tekanan
hidrostatik akibat tinggi cairan di atas gelembung. Wujud saat gelembung
terbentuk dengan giat disebut dengan mendidih,
dan temperatur saat mendidih ini disebut dengan titik didih. Titik didih pada tekanan atmosfer 1 atm disebut
dengan titik didih normal. Titik
didih akan berubah bergantung pada tekanan atmosfer. Bila tekanan atmosfer
lebih tinggi dari 1 atm, titik didih akan lebih tinggi dari titik didih normal.
Sementara bila tekanan atmosfer lebih rendah dari 1 atm, titik didihnya akan
lebih rendah dari titik didih normal. Titik didih dan perubahannya dengan
tekanan bersifat khas untuk tiap senyawa. Jadi titik didih adalah salah satu
sarana untuk mengidentifikasi zat. Titik didih ditentukan oleh massa molekul
dan kepolaran molekul. Di antara molekul dengan jenis gugus fungsional polar
yang sama, semakin besar massa molekulnya, semakin tinggi titik didihnya
(Takeuchi, 2006).
2.4 Kenaikan Titik Didih
Bila dibandingkan tekanan uap larutan
pada suhu yang sama lebih rendah dari tekanan uap pelarutnya. Jadi, titik didih
normal larutan, yakni suhu saat fasa gas pelarut mencapai 1 atm, harus lebih
tinggi daripada titik didih pelarut. Fenomena ini disebut dengan kenaikan titik
didih larutan. Dengan menerapkan hukum Raoult pada larutan ideal, kita dapat
memperoleh hubungan berikut:
pA
= p0A xA = p0A [nA
/(nA + nB)]
(p0A-
pA)/ p0A = 1 - xA = xB
xA
dan xB adalah fraksi mol, dan nA dan nB adalah
jumlah mol tiap komponen. Persamaan ini menunjukkan bahwa, untuk larutan ideal
dengan zat terlarut tidak mudah menguap, penurunan tekanan uap sebanding dengan
fraksi mol zat terlarut.
Untuk larutan
encer, yakni nA + nB hampir sama dengan nA,
jumlah mol nB dan massa pada konsentrasi molal mB diberikan dalam
ungkapan.
xB
= nB/(nA + nB) . nB/nA= nB/(1/MA)
= MAmB
MA adalah massa molar pelarut A. Untuk
larutan encer, penurunan tekanan uap sebanding dengan mB, massa konsentrasi
molal zat terlarut B. Perbedaan titik didih larutan dan pelarut disebut dengan kenaikan
titik didih, ΔTb. Untuk larutan encer, kenaikan titik didih sebanding dengan
massa konsentrasi molal zat terlarut B.
ΔTb = Kb mB
Tetapan
kesebandingan Kb khas untuk setiap pelarut dan disebut dengan kenaikan titik didih molal (Takeuchi, 2006).
2.5
Aplikasi
Percobaan Kenaikan Titik Didih Dalam Industri “Pembuatan n-Butanol Dengan
Proses Fermentasi”
Bahan baku yang biasa digunakan untuk menghasilkan
n-butanol pada proses fermentasi adalah molase. Molase merupakan hasil samping
dari industri gula yang diperoleh setelah sukrosa dikristalisasi dan
disentrifusi dari sari gula tebu.
Proses fermentasi molase menggunakan kultur bakteri.
Bakteri ini dapat mengubah glukosa menjadi n-butanol dan gas. Molase bersama
kultur bakteri dimasukkan ke dalam tangki fermentasi yang beroperasi pada
kondisi aerob. Pada proses ini akan terbentuk gas CO2 dan hidrogen.
Gas-gas ini ditampung untuk kemudian di recovery.
Reaksi fermentasi:
(C6H10O5)x => C6H12O6 => CH3COCH3
+ CH3CH2CH2OH + C2H5OH
+ CO2+ H2
Alkohol hasil
fermentasi merupakan alkohol berkadar rendah yang disebut beer. Alkohol ini kemudian dibawa ke kolom beer. Kolom ini berjumlah 2 buah dan berfungsi untuk menaikkan
konsentrasi alkohol yang diperoleh. Hasil atas beer kolom kedua dibawa ke kolom distilasi pertama untuk memisahkan
aseton dari alkohol. Hasil bawah kolom beer
dibawa ke kolom distilasi kedua untuk memperoleh
n-butanol
dengan kemurnian 96 %. Selain n-butanol, proses ini juga menghasilkan aseton
dan etanol. Tiap 1 gallon molase mengandung 6 lb gula yang akan menghasilkan
1,45 lb n-butanol; 0,4 lb aseton ; dan 0,07 lb campuran etanol, CO2,
dan hidrogen (Halimatuddahliana, 2004).
Gambar 2.1 Flowsheet
Pembuatan n-Butanol Secara Fermentasi
(Halimatuddahliana, 2004)
BAB III
METODOLOGI PERCOBAAN
3.1 Bahan dan Peralatan
3.1.1 Bahan dan Fungsi
Adapun bahan beserta fungsinya adalah sebagai berikut:
1.
Natrium klorida
(NaCl)
Fungsi: sebagai bahan percobaan yang dicari titik
didihnya.
2.
D-glukosa (C6H12O6)
Fungsi: sebagai bahan percobaan yang dicari titik didihnya.
3. Aquades (H2O)
Fungsi: sebagai pelarut.
3.1.2 Peralatan dan Fungsi
Adapun peralatan beserta fungsinya adalah sebagai berikut:
1.
Labu
distilasi
Fungsi: sebagai wadah pelarut yang akan menguapkan larutan.
2.
Neraca
elektrik
Fungsi: sebagai alat pengukur jumlah massa zat terlarut
3.
Termometer
Fungsi: untuk mengukur suhu larutan.
4.
Gelas
ukur
Fungsi: mengukur volume larutan dan sebagai wadah larutan
yang akan dididihkan.
5.
Batang
pengaduk
Fungsi: membantu mengaduk dalam pembuatan larutan.
6.
Pipa
bengkok
Fungsi: untuk mengalirkan uap dari labu distilasi ke gelas ukur.
7.
Pipa
kapiler
Fungsi: untuk mengalirkan uap ke udara.
8.
Bunsen
Fungsi: sebagai sumber panas.
9.
Kaki
tiga dan kasa
Fungsi: sebagai alat untuk menopang tabung distilasi.
10.
Statif
dan klem
Fungsi: untuk menyangga labu distilasi agar tidak jatuh.
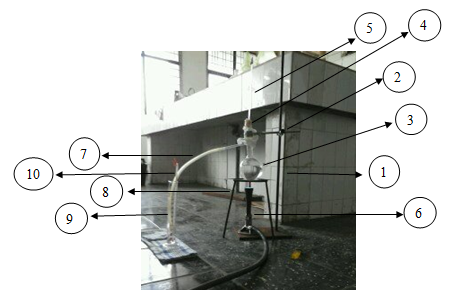
3.2 Rangkaian Peralatan
Gambar 3.1 Rangkaian Alat Percobaan Kenaikan Titik
Didih Metode Landsberger
Keterangan gambar :
1.
Statif 6.
Bunsen
2.
Klem 7. Pipa bengkok
3.
Labu
distilasi 8.
Kaki tiga
4.
Gabus 9.
Gelas ukur
5.
Pipa kapiler 10. Termometer
3.3 Prosedur Percobaan
3.3.1
Prosedur Percobaan Kalibrasi
1.
Dirangkai alat
yang akan digunakan.
2.
Labu distilasi diisi dengan air hingga
2/3 bagian volumenya, lalu ditutup dengan gabus yang
dilengkapi dengan pipa kapiler.
3.
Air dalam labu distilasi dipanaskan sampai mendidih,
dan uapnya digunakan untuk mendidihkan aquades dalam gelas ukur sebanyak 11 ml.
4. Kemudian diukur suhu saat aquades dalam gelas ukur mendidih sebagai suhu kalibrasi.
3.3.2
Kenaikan Titik Didih Metode Landsberger
1.
Dirangkai alat
yang akan digunakan.
2.
Labu distilasi diisi dengan air hingga
2/3 bagian volumenya, lalu ditutup dengan gabus yang
dilengkapi pipa kapiler.
3.
Gelas ukur diisi dengan
air sebanyak 11 ml dan ditambahkan sampel sesuai penugasan.
4.
Diaduk dan kemudian diukur volumenya sebagai V1.
5.
Air dalam labu distilasi dipanaskan sampai mendidih,
dan uapnya digunakan untuk mendidihkan larutan dalam gelas ukur.
6.
Suhu pada saat larutan mendidih dicatat.
7.
Diukur volume larutan sebagai V2.
8.
Percobaan diulangi untuk run berikutnya.
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Percobaan Kalibrasi
4.1.1 Kalibrasi
Pelarut
V pelarut awal (V0) : 11
ml
Titik didih kalibrasi : 90
oC
4.1.2 Penentuan
Titik Didih Dengan Metode Landsberger
Sampel
Natrium
Klorida (NaCl)
Tabel 4.1 Hasil
Percobaan untuk Sampel Kalium Klorida
Run
|
W (gr)
|
V1 (ml)
|
V2 (ml)
|
m1
|
m2
|
Td (oC)
|
∆Td (oC)
|
1
|
0,2
|
94
|
11,5
|
18
|
0,31
|
0,20
|
94
|
2
|
0,6
|
96
|
12,5
|
20,5
|
0,85
|
0,52
|
96
|
3
|
0,8
|
97
|
13
|
21
|
1,09
|
0,67
|
97
|
4
|
0,9
|
98
|
13,5
|
22
|
1,18
|
0,72
|
98
|
Kdteori = 7,590oC/molal
Sampel
Fruktosa (C6H12O6)
Tabel 4.2 Hasil Percobaan untuk Sampel Fruktosa
(C6H12O6)
Run
|
W (gr)
|
V1 (ml)
|
V2 (ml)
|
m1
|
m2
|
Td (oC)
|
∆Td (oC)
|
1
|
0,1
|
91
|
11,5
|
18,5
|
0,052
|
0,032
|
91
|
2
|
0,3
|
93
|
11,6
|
19,5
|
0,157
|
0,091
|
93
|
3
|
0,4
|
94
|
11,7
|
20
|
0,209
|
0,119
|
94
|
4
|
0,6
|
95
|
12
|
21,5
|
0,314
|
0,168
|
95
|
Kdteori = 7,467 oC/mola
Sampel Glukosa (C6H12O6)
Tabel
4.3 Hasil Percobaan untuk Sampel Glukosa (C6H12O6)
Run
|
W (gr)
|
V1 (ml)
|
V2 (ml)
|
m1
|
m2
|
Td (oC)
|
∆Td (oC)
|
1
|
0,1
|
92
|
11,5
|
18
|
0,052
|
0,033
|
92
|
2
|
0,3
|
93
|
11,6
|
20
|
0,157
|
0,089
|
93
|
3
|
0,4
|
94
|
11,7
|
21
|
0,209
|
0,113
|
94
|
4
|
0,6
|
96
|
12
|
22,5
|
0,314
|
0,160
|
96
|
Kdteori = 7,508 oC/molal
4.2 Pembahasan
4.2.1 Pengaruh
Fraksi Mol Zat Terlarut Terhadap Penurunan Tekanan Uap Larutan
Dibawah
ini adalah Gambar 4.1 yaitu
grafik yang menyatakan pengaruh fraksi
mol zat terlarut Natrium Klorida (X2)
terhadap penurunan Tekanan
Uap larutan Natrium Klorida (ΔP), gambar 4.2 yaitu
grafik yang menyatakan pengaruh fraksi
mol zat terlarut Fruktosa (X2)
terhadap penurunan Tekanan
Uap larutan Fruktosa (ΔP), dan gambar 4.3 yaitu
grafik yang menyatakan pengaruh fraksi
mol zat terlarut Glukosa (X2)
terhadap penurunan Tekanan
Uap larutan Glukosa (ΔP).
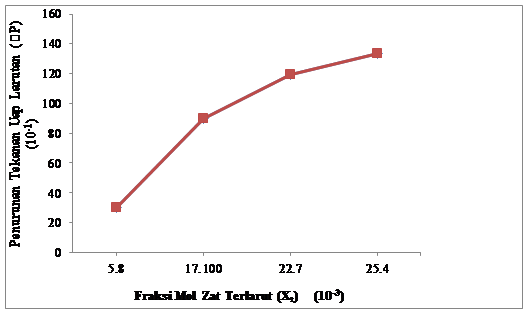
Gambar 4.1 Pengaruh Fraksi Mol NaCl Terhadap Penurunan Tekanan Uap Larutan NaCl
(∆P)
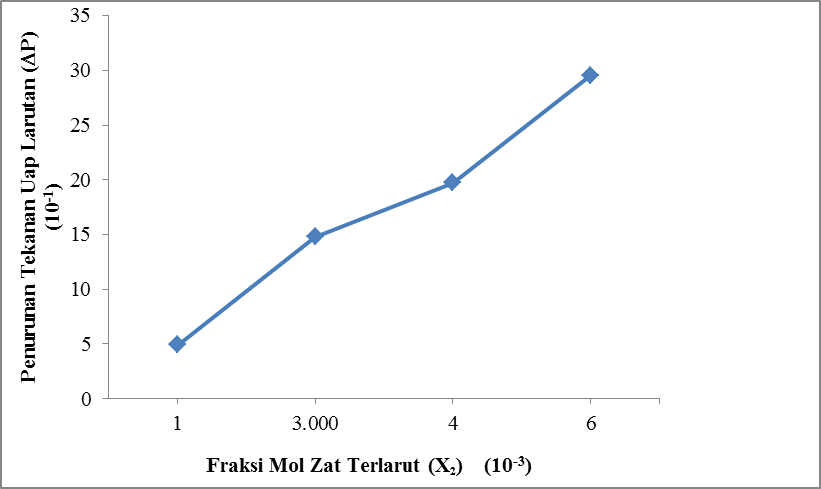
Gambar 4.2 Pengaruh Fraksi Mol Fruktosa Terhadap Penurunan Tekanan Uap Larutan Fruktosa
(∆P)
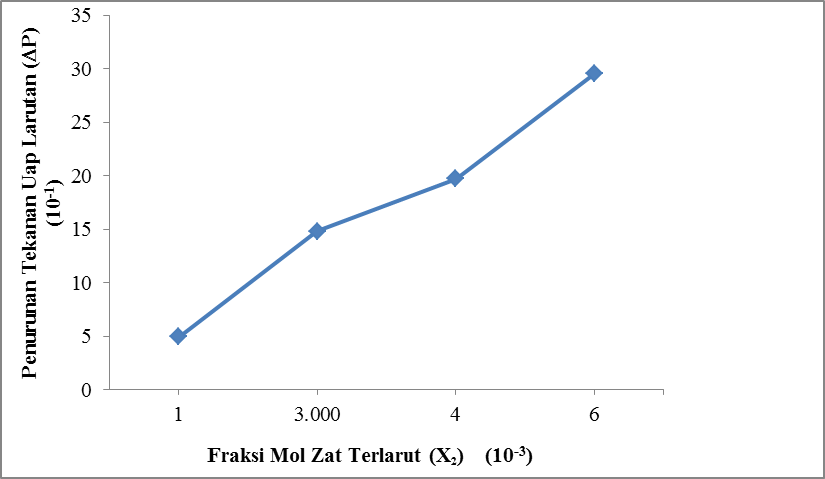
Gambar 4.3 Pengaruh Fraksi Mol Glukosa Terhadap Penurunan Tekanan Uap Larutan Glukosa
(∆P)
Dari gambar 4.1 ditunjukkan bahwa fraksi mol zat terlarut NaCl (X2)
berbanding lurus dengan penurunan
tekanan uap larutan Natium Klorida (∆P). Pada run I dengan fraksi mol 5,8. 10-3 diperoleh penurunan tekanan uap larutan NaCl (∆P) sebesar 3,0323 kPa. Pada run II dengan fraksi mol 17,1 10-3 diperoleh penurunan tekanan uap larutan NaCl (∆P) sebesar 8,9931 kPa dan pada run III dengan fraksi mol 22,7 . 10-3
diperoleh penurunan tekanan
uap larutan NaCl
(∆P) sebesar 11,9228 kPa sedangkan pada run IV dengan fraksi mol 25,4. 10-3 diperoleh penurunan tekanan uap larutan NaCl (∆P) sebesar 1,584913,3753 kPa.
Dari gambar 4.2 ditunjukkan bahwa fraksi mol zat terlarut Fruktosa (X2) berbanding lurus dengan penurunan tekanan uap larutan Fruktosa (∆P).
Pada run I dengan fraksi mol
1. 10-3 diperoleh penurunan tekanan uap larutan Fruktosa
(∆P) sebesar 0,495 kPa. Pada run II dengan fraksi mol 3 10-3 diperoleh penurunan tekanan uap larutan Fruktosa
(∆P) sebesar 1,481 kPa dan pada run III dengan fraksi mol 4 . 10-3 diperoleh penurunan tekanan uap larutan Fruktosa
(∆P) sebesar 1,973 kPa sedangkan pada run IV dengan fraksi mol 6. 10-3 diperoleh penurunan tekanan uap larutan Fruktosa
(∆P) sebesar 2,954 kPa.
Dari gambar 4.3 ditunjukkan bahwa fraksi mol zat terlarut Glukosa (X2) berbanding lurus dengan penurunan tekanan uap larutan Glukosa (∆P).
Pada run I dengan fraksi mol
1. 10-3 diperoleh penurunan tekanan uap larutan Glukosa
(∆P) sebesar 0,475 kPa. Pada run II dengan fraksi mol 3 10-3 diperoleh penurunan tekanan uap larutan Glukosa
(∆P) sebesar 1,461 kPa dan pada run III dengan fraksi mol 4 . 10-3 diperoleh penurunan tekanan uap larutan Glukosa (∆P) sebesar 1,983 kPa sedangkan pada run IV dengan fraksi mol 6. 10-3 diperoleh penurunan tekanan uap larutan Glukosa
(∆P) sebesar 2,964 kPa.
Dari hasil percobaan yang telah dilakukan dapat disimpulkan
hasil percobaan yang diperoleh sesuai dengan teori.
4.2.2
Pengaruh Molalitas (m) Terhadap Kenaikan Titik Didih
Dibawah ini Gambar 4.4 yaitu grafik yang menyatakan
pengaruh molalitas Natrium Klorida (NaCl) (m) terhadap kenaikan titik didih
larutan NaCl
(ΔTd),
Gambar 4.5 yaitu grafik yang menyatakan
pengaruh molalitas Glukosa (m) terhadap kenaikan titik didih larutan Glukosa
(ΔTd), dan Gambar 4.6
yaitu grafik yang menyatakan pengaruh molalitas Fruktosa (m) terhadap kenaikan
titik didih larutan Fruktosa (ΔTd).
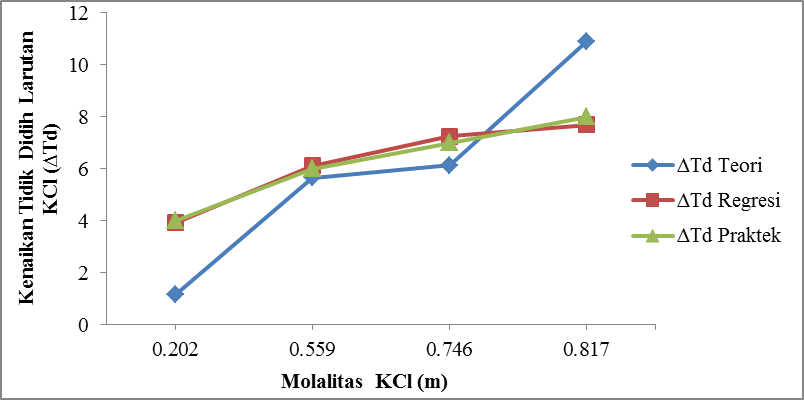
Gambar 4.4 Pengaruh Molalitas NaCl (m) Terhadap Kenaikan Titik Didih Larutan NaCl (∆Td)
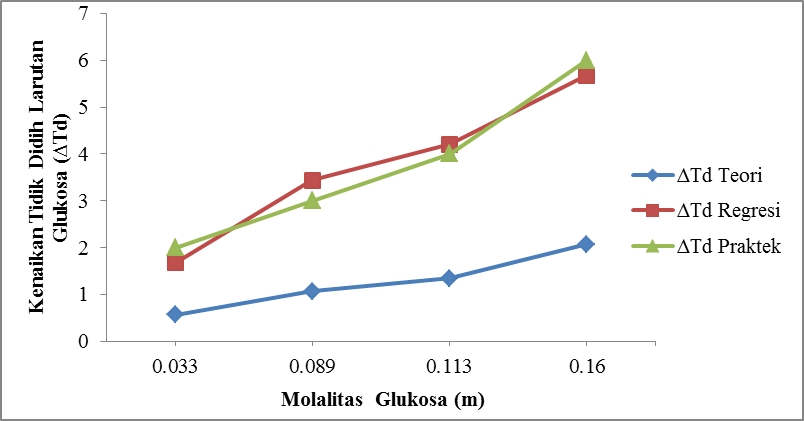
Gambar 4.5 Pengaruh Molalitas Glukosa (m) Terhadap Kenaikan Titik Didih Larutan Glukosa
(∆Td)
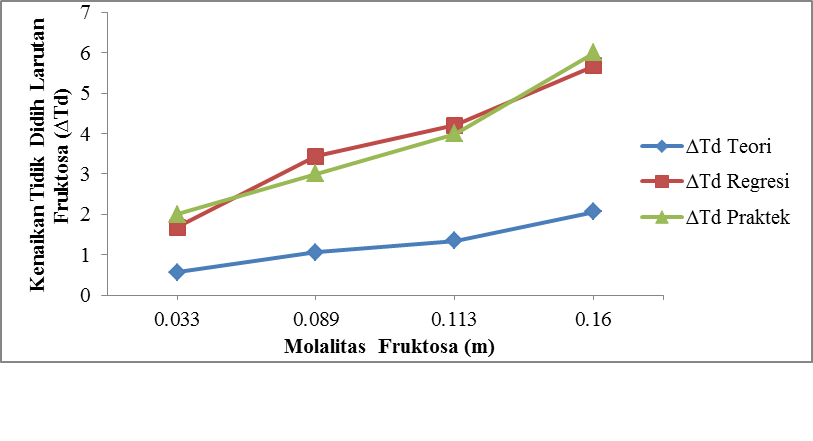
Gambar 4.6 Pengaruh Molalitas Fruktosa (m) Terhadap Kenaikan Titik Didih Larutan Fruktosa
(∆Td)
Dari gambar 4.4 ditunjukkan bahwa molalitas Natrium Klorida (m)
berbanding lurus dengan kenaikan titik didih larutan Natrium
Klorida (∆Td). Pada run I dengan konsentrasi
0,202 molal diperoleh kenaikan titik didih (∆Td) 4 oC, pada run II dengan
konsentrasi 0,559 molal diperoleh kenaikan titik didih (∆Td) 6 oC dan pada run III
dengan konsentrasi 0,746 molal diperoleh kenaikan titik didih (∆Td) 7 oC. Sedangkan pada run IV dengan konsentrasi 0,817 molal diperoleh kenaikan titik didih (∆Td) sebesar 8 oC.
Dari gambar 4.5 ditunjukkan bahwa molalitas Glukosa (m) berbanding lurus dengan kenaikan titik didih larutan Glukosa (∆Td). Pada run I
dengan konsentrasi 0,033 molal diperoleh kenaikan titik didih (∆Td) 2 oC, pada run II dengan
konsentrasi 0,089 molal diperoleh kenaikan titik didih (∆Td) 3 oC dan pada run III
dengan konsentrasi 0,113 molal diperoleh kenaikan titik didih (∆Td) 4 oC. Sedangkan pada
run IV dengan konsentrasi 0,160 molal diperoleh kenaikan titik didih (∆Td) sebesar 6 oC.
Dari gambar 4.6 ditunjukkan bahwa molalitas Fruktosa (m) berbanding lurus dengan
kenaikan titik didih larutan Fruktosa (∆Td). Pada run I dengan konsentrasi 0,032
molal diperoleh kenaikan titik didih (∆Td)
1 oC, pada run II dengan konsentrasi 0,091 molal diperoleh kenaikan
titik didih (∆Td)
3 oC dan pada run III dengan konsentrasi 0,119 molal
diperoleh kenaikan titik didih (∆Td)
4 oC.
Sedangkan pada run IV dengan konsentrasi 0,168 molal diperoleh kenaikan titik didih (∆Td) sebesar 5 oC.
Hasil eksperimen Roult menunjukan
bahwa Kenaikan titik didih larutan akan semakin besar apabila konsentrasi
(molal) dari zat terlarut semakin besar. Titik didih larutan akan lebih tinggi
dari titik didih pelarut murni. Hal ini juga diikuti dengan penurunan titik
beku pelarut murni, atau titik beku larutan lebih kecil dibandingkan titik beku
pelarutnya. Roult menyederhanakan ke dalam persamaan:
ΔTb
= kb . m
Perubahan titik didih atau ΔTb
merupakan selisih dari titik didih larutan dengan titik didih pelarutnya,
seperti persamaan :
ΔTb
= Tb – Tbº
Hal yang berpengaruh pada kenaikan
titik didih adalah harga kb dari zat pelarut. Kenaikan tidak dipengaruhi oleh
jenis zat yang terlarut, tapi oleh jumlah partikel atau mol terlarut khususnya
yang terkait dengan proses ionisasinya. Untuk zat terlarut yang bersifat
elektrolit persamaan untuk kenaikan titik didik harus dikalikan dengan faktor
ionisasi larutan, sehingga persamaannya menjadi :
ΔTb
= kb . m.i
(Dina, 2012)
Keterangan:
Tb = kenaikan titik
didih larutan
Kb = tetapan kenaikan
titik didih molal pelarut (kenaikan titik didih untuk 1 mol zat dalam 1000 gram
pelarut)
m = molal larutan (mol/100 gram pelarut)
i = faktor van’t hoff
Dari hasil percobaan yang telah
dilakukan dapat disimpulkan hasil percobaan yang diperoleh
adalah sesuai dengan teori.
4.2.3
Perbandingan Kenaikan Titik Didih Larutan Dengan Berat
Molekul yang Sama
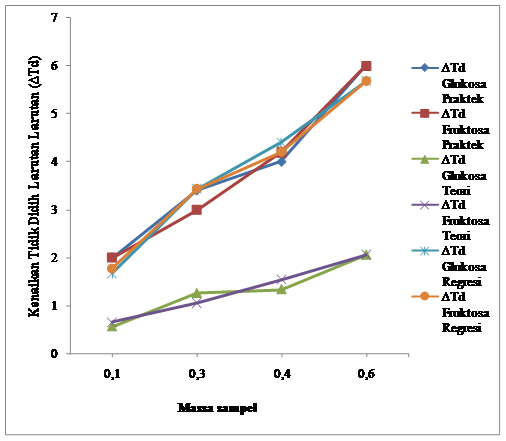
Gambar 4.7
Perbandingan Antara Kenaikan Titik Didih Larutan Glukosa dengan Kenaikan Titik
Didih Larutan Fruktosa
Dari gambar ditunjukkan bahwa pada massa Fruktosa dan Glukosa yang sama, ada
perbedaan kenaikan titik didih antara kedua larutan.
Pada run I dengan massa 0,1 gram, kenaikan titik didih (∆Td) glukosa adalah 2 oC
sedangkan kenaikan titik didih (∆Td)
fruktosa adalah 1 oC, pada run II dengan massa 0,3 gram, kenaikan
titik didih (∆Td)
glukosa adalah 3 oC sedangkan kenaikan titik didih (∆Td) fruktosa adalah 3 oC,
pada run III dengan massa 0,4 gram, kenaikan titik didih (∆Td) glukosa adalah 4 oC
sedangkan kenaikan titik didih (∆Td)
fruktosa adalah 4 oC, pada run IV dengan massa 0,6 gram, kenaikan
titik didih (∆Td)
glukosa adalah 6 oC sedangkan kenaikan titik didih (∆Td) fruktosa adalah 5 oC.
Secara
teori, titik leleh glukosa adalah 146 oC dan titik leleh fruktosa
adalah 103 oC. Maka, titik leleh glukosa lebih tinggi daripada titik
leleh fruktosa (Sciencelab, 2012).
Hasil
percobaan menyatakan bahwa kenaikan titik didih (∆Td) glukosa lebih besar daripada
kenaikan titik didih (∆Td)
fruktosa. Maka percobaan ini, sesuai dengan teori.
Halimatuddahliana. 2004. Pembuatan n-Butanol Dengan Proses Fermentasi. Universitas Sumatera
Utara : Fakultas Teknik
Geankoplis, C.J. 1993. Transport Processes and Separation Process Principles. Edisi
Keempat. New Jersey : Pearson Education, Inc
Kadri, A.
2009. Kimia Medik. Medan : Fakultas
Kedokteran Universitas Sumatera Utara
Perry,
Robert H., Green, Don W., Maloney, James O. 1997. Chemical Engineer’s Handbook. Edisi Keenam. McGraw-Hill Book
Company
Sukardjo.
1997. Kimia Fisika. Jakarta : Rineka
Cipta
Takeuchi, Yashito. 2006. Pengantar Kimia. Tokyo: Muki Kagaku